备案号:辽ICP备19007957号-1
![]() 聆听您的声音:feedback@highmark.com.cn企业热线:400-778-8318
聆听您的声音:feedback@highmark.com.cn企业热线:400-778-8318
Copyright ©2015- 海马课堂网络科技(大连)有限公司办公地址:辽宁省大连市高新技术产业园区火炬路32A号创业大厦A座18层1801室
您是否想过,为什么煎鸡蛋时蛋清的颜色会从透明变为不透明? 如果想过,本文的内容就是为您准备的!蛋白质的形状对其功能非常重要。要了解蛋白质的最终形状或形态,我们需要了解蛋白质结构的四个层次:一级结构、二级结构、三级结构和四级结构。接下来的内容可能比较复杂,请同学们认真阅读。

每种蛋白质都有独特的形状。当蛋白质所处环境的温度或酸碱度发生变化,或者接触到化学物质时,这些相互作用就会被破坏,导致蛋白质失去三维结构,重新变成无结构的氨基酸链。当蛋白质失去主序和高阶结构时,就被称为变性。变性蛋白质一般不具有功能。
对于某些蛋白质来说,变性是可以逆转的。多肽的一级结构仍然完好无损(因为氨基酸尚未分离),所以当它回到正常环境中时,可以折叠成有功能的形式。 但在其他情况下,变性是永久性的。煎鸡蛋就是蛋白质不可逆变性的一个例子。液态蛋白中的白蛋白在炉子的热量作用下变性,变成不透明的固体,鸡蛋冷却后也不会恢复原状。
研究人员发现,有些蛋白质变性后,即使单独放在试管中也能重新折叠。由于这些蛋白质可以在非结构化状态下折叠,因此它们的氨基酸序列必须包含折叠所需的所有信息。然而,并不是所有蛋白质都能使用这一招,蛋白质在细胞中的正常折叠方式似乎更为复杂:许多蛋白质并不是自己折叠,而是在伴侣蛋白(伴侣蛋白)的帮助下折叠。
1.一级结构
蛋白质结构中最简单的一级结构是多肽链中氨基酸的排列顺序。例如,激素胰岛素由两条多肽链 A 和 B 组成,每条肽链都有一组独特的氨基酸,这些氨基酸以特定的顺序排列在一起。例如,A 链的序列从 N 端的甘氨酸开始,到 C 端的天冬酰胺结束,这与 B 链的序列不同。蛋白质的序列由编码该蛋白质(或多组分蛋白质中的部分蛋白质)的基因的 DNA 序列决定。 基因 DNA 序列的改变会导致蛋白质氨基酸序列的改变。蛋白质序列中单个氨基酸的变化会影响其整体结构和功能。
单个氨基酸的变化与镰状细胞性贫血(一种影响红细胞的遗传性疾病)有关。在镰状细胞贫血症中,组成血红蛋白(血液中携带氧气的蛋白质)的多肽链之一的序列发生了轻微变化。谷氨酸通常是血红蛋白 beta 链(组成血红蛋白的两种蛋白质链之一)的第六个氨基酸,但被缬氨酸取代。下图中显示了 β 链片段的这种取代。
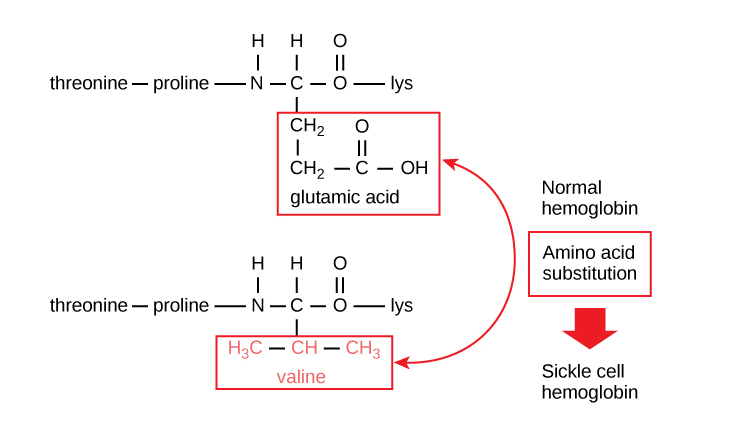
血红蛋白分子的最大特点是由两条α链和两条β链组成,每条α链由大约 150 个氨基酸组成,因此整个蛋白质中共有大约 600 个氨基酸。正常血红蛋白分子与镰状细胞血红蛋白分子之间的差别仅在于约 600 个氨基酸中的 2 个。
身体只产生镰状细胞血红蛋白的人会出现镰状细胞贫血的症状。出现这些症状是因为氨基酸谷氨酰胺变成了氨基酸缬氨酸,导致血红蛋白分子积聚成长长的纤维。这些纤维使红细胞从盘状变形为月牙状。
镰状细胞在试图通过血管时会被卡住。被卡住的细胞会阻碍血液流动,导致镰状细胞性贫血患者出现气短、头晕、头痛和腹痛等严重健康问题。
2.二级结构
蛋白质结构的下一个层次是二级结构,指的是多肽中由于主链原子之间的相互作用而形成的局部折叠结构(主链仅指 R 基团以外的多肽链--我们的意思是二级结构不包括 R 基团原子)。这两种结构都是通过一种氨基酸的羰基 O 和另一种氨基酸的氨基 H 之间形成的氢键来保持形状的。在 α 螺旋中,氨基酸的羰基(C=O)与氨基酸链下四个位置的氨基酸的氨基 H(N-H)形成氢键(例如,氨基酸 1 的羰基与氨基酸 5 的 N-H 形成氢键)。(例如,氨基酸 1 的羰基与氨基酸 5 的 N-H 形成氢键)。这种键合方式使多肽链形成类似盘带的螺旋结构,螺旋的每一圈含有 3.6 个氨基酸。氨基酸的 R-基团可以远离 α-螺旋,自由地相互作用。
在 β 折叠片中,多肽链的两个或多个片段并排排列,形成由氢键固定在一起的片状结构。氢键是在骨架的羰基和氨基之间形成的,R 基团延伸到薄片平面的上方和下方。 折叠的 β-片状结构的链可以是平行的,朝向相同的方向(即 N 端和 C 端相匹配),也可以是反平行的,朝向相反的方向(即一条链的 N 端紧靠另一条链的 C 端)。
某些氨基酸或多或少会出现在 α 螺旋或 β 折叠片中。例如,氨基酸脯氨酸有时被称为 "螺旋破坏者",因为它不寻常的 R 基(与氨基结合形成环状)会使链产生弯曲,与螺旋的形成不相容。
\脯氨酸通常存在于弯曲部位,即二级结构之间的非结构区域。同样,色氨酸、酪氨酸和苯丙氨酸等氨基酸的 R 基具有大的环状结构,它们通常存在于折叠的 β 片状结构中,这可能是因为折叠的 β 结构为侧链提供了充足的空间。
许多蛋白质同时含有α-螺旋和折叠β-片层,但也有一些蛋白质只含有一种二级结构或两种结构都没有。
3.三级结构
多肽的整体三维结构称为三级结构。 三级结构主要来自组成蛋白质的氨基酸的 R 基团之间的相互作用。
构成三级结构的 R 基团之间的相互作用包括氢键、离子键、偶极子-偶极子相互作用、伦敦分散力以及各种非共价键。例如,电荷相同的 R 基团会相互排斥,而电荷相反的 R 基团可以形成离子键。同样,极性 R 基团可以形成氢键和其他偶极-偶极相互作用。疏水相互作用在三级结构中也很重要,在三级结构中,带有非极性疏水 R 基团的氨基酸在蛋白质内部形成簇,而亲水氨基酸则留在外部,与周围的水分子相互作用。
最后,一种特殊类型的共价键也能促进三级结构的形成:二硫键。二硫键是半胱氨酸硫侧链之间的共价键,比其他类型的三级结构键更强。二硫键就像分子中的 "安全别针",将多肽的各个部分固定在一起。
4.四级结构
大多数蛋白质由单条多肽链组成,只有类似刚才描述的三级结构。不过,有些蛋白质由多条多肽链(也称为亚基)组成。当这些亚基连接在一起时,就形成了蛋白质的四级结构。
我们已经找到了四层结构蛋白质的一个例子,即血红蛋白。如前所述,血红蛋白在血液中运输氧气,由四个亚基组成,α 和 β 型各两个。另一个例子是 DNA 聚合酶,它是一种合成新 DNA 链的酶,由 10 个亚基组成。
一般来说,与三级结构相同的相互作用类型(主要是氢键和弱相互作用,如伦敦分散力)将亚基结合在一起并形成四级结构。
海马课堂专业课程辅导
①3500+海外硕博导师,Highmark承诺导师真实教育背景,假一赔三!
③根据学生情况进行1V1专属备课,辅导不满意随心退!
②试听课全面升级!让留学生听得安心!
④课程辅导产品升级赠送考前检验。
⑤中英双语详细讲解课程中的考点、难点问题,提供多方位的课后辅导!

阅读原文:https://www.highmarktutor.com/news/16521_59.html
版权作品,未经海马课堂 highmarktutor.com 书面授权,严禁转载,违者将被追究法律责任。

备案号:辽ICP备19007957号-1
![]() 聆听您的声音:feedback@highmark.com.cn企业热线:400-778-8318
聆听您的声音:feedback@highmark.com.cn企业热线:400-778-8318
Copyright ©2015- 海马课堂网络科技(大连)有限公司办公地址:辽宁省大连市高新技术产业园区火炬路32A号创业大厦A座18层1801室
hmkt088